
氧化還原反應(yīng)是在反應(yīng)前后元素的氧化數(shù)具有相應(yīng)的升降變化的化學(xué)反應(yīng)。在反應(yīng)過程中有元素化合價(jià)變化的化學(xué)反應(yīng)叫做氧化還原反應(yīng)。這種反應(yīng)可以理解成由兩個(gè)半反應(yīng)構(gòu)成,即氧化反應(yīng)和還原反應(yīng)。此類反應(yīng)都遵守電荷守恒。在氧化還原反應(yīng)里,氧化與還原然以等量同時(shí)行。兩者可以比喻為陰陽之間相互依靠、轉(zhuǎn)化、消長且互相對立的關(guān)系。有機(jī)化學(xué)中也存在氧化還原反應(yīng)。
反應(yīng)實(shí)質(zhì)
1.發(fā)生了電子的轉(zhuǎn)移。(即在離子化合物中是電子的得失,在共價(jià)化合物里是電子的偏移。在反應(yīng)物之間電子
發(fā)生轉(zhuǎn)移的反應(yīng),又稱為氧化還原反應(yīng))。 1(1)氧化還原反應(yīng)不定是得失氧原子,而是何降低價(jià)態(tài)或升價(jià)態(tài)的何元素都可以成為氧化或還原(反應(yīng))。
某物質(zhì)中的何元素失去電子(即化合價(jià)升)的反應(yīng)叫氧化反應(yīng)/有元素化合價(jià)降低(得電子)的反應(yīng)叫還原反應(yīng),既得氧又失氧的反應(yīng)叫氧化還原反應(yīng)
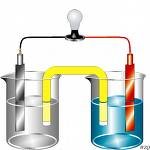 氧化還原反應(yīng)(原電池中的氧化還原)2.強(qiáng)弱律:反應(yīng)中滿足:氧化性:氧化劑>氧化產(chǎn)物
氧化還原反應(yīng)(原電池中的氧化還原)2.強(qiáng)弱律:反應(yīng)中滿足:氧化性:氧化劑>氧化產(chǎn)物
還原性:還原劑>還原產(chǎn)物>氧化產(chǎn)物
3.價(jià)態(tài)律:元素處于zui價(jià)態(tài),只具有氧化性;元素處于態(tài),只具有還原性;處于中間價(jià)態(tài),既具氧化性,又具有還原性。
4.不交叉原則:同種元素不同價(jià)態(tài)間發(fā)生歸中反應(yīng)時(shí),元素的化合價(jià)只接近而不交叉,zui多只能達(dá)到同種價(jià)態(tài)
5.強(qiáng)則優(yōu)原則:在同氧化還原反應(yīng)中,氧化劑遇多種還原劑時(shí),和zui強(qiáng)還原劑反應(yīng)
6. 歸中律:不同價(jià)態(tài)的同種元素,其較價(jià)態(tài)與較低價(jià)態(tài)均轉(zhuǎn)化為中間價(jià)態(tài),不得交錯升降。
 氧化還原反應(yīng)中各物質(zhì)關(guān)系還原劑 + 氧化劑 ---> 氧化產(chǎn)物 + 還原產(chǎn)物
氧化還原反應(yīng)中各物質(zhì)關(guān)系還原劑 + 氧化劑 ---> 氧化產(chǎn)物 + 還原產(chǎn)物
般來說,同反應(yīng)中還原產(chǎn)物的還原性比還原劑弱,氧化產(chǎn)物的氧化性比氧化劑弱,這就是所謂“強(qiáng)還原劑制弱還原劑,強(qiáng)氧化劑制弱氧化劑”。
總結(jié):氧化劑發(fā)生還原反應(yīng),得電子,化合價(jià)降低,有氧化性,被還原,生成還原產(chǎn)物。
還原劑發(fā)生氧化反應(yīng),失電子,化合價(jià)升,有還原性,被氧化,生成氧化產(chǎn)物。
注意(此處以氧原子為例)
口訣:升失氧還,降得還氧
上一篇 : 美華儀為您解析透明度
下一篇 : orp 與ph的區(qū)別
